Sifat dan Kegunanaan Dari Unsur-Unsur Golongan Halogen (VII A)
Daftar Isi
Halogen adalah enam unsur nonlogam, sangat reaktif di bawah Golongan VII A(kolom 17) dari tabel periodik. Mereka adalah bahan pengoksidasi yang sangat kuat, yang berarti mereka mengambil elektron dari zat lain. Mereka juga sangat reaktif dan biasanya membentuk garam dengan Golongan I A, yaitu logam alkali.
Nama halogen secara harfiah berarti penghasil garam. Halogen dalam bentuk unsur tidak ada di alam karena sangat reaktif. Banyak senyawa halogen juga sangat reaktif dan memiliki sifat pengoksidasi, menjadikannya ideal sebagai disinfektan.
Banyak produk pemutih pakaian, misalnya, memiliki senyawa berbasis halogen, seperti natrium hipoklorit. Senyawa halogen memiliki berbagai aplikasi, termasuk sanitasi air, produksi kertas, sintesis polimer plastik, dan pemurnian minyak bumi
Sifat Umum dari Halogen
Sama seperti golongan lain dalam tabel periodik unsur, enam unsur dalam kolom 17 memiliki sifat kimia dan fisika yang serupa. Ini terutama karena struktur atom dan konfigurasi elektronnya
Sifat Kimia
Halogen memiliki tujuh elektron valensi pada tingkat energi terluarnya, yang dapat dilambangkan dengan ns2np5. Selain itu, mereka semua memiliki orbital ‘s’ (bentuk bulat) dan ‘p’ (bentuk halter) di kulit terluar. Semua halogen sangat elektronegatif karena muatan inti efektif yang tinggi dari unsur-unsur tersebut.
Keelektronegatifan mengukur kemampuan atau kecenderungan atom untuk menarik elektron baik dalam ikatan kovalen bersama atau dalam ikatan ionik. Oleh karena itu, elektronegativitas yang lebih tinggi berarti reaktivitas yang lebih kuat.
Sebagai unsur, halogen ada sebagai molekul diatomik (molekul yang terdiri dari dua atom). Namun, ketika jari-jari atom meningkat, stabilitas ikatan diatomik menurun.
Fluor adalah unsur yang paling reaktif dari semua halogen. Pada kenyataannya itu dapat dikatakan bahwa itu adalah elemen alami yang paling reaktif yang kita ketahui. Bahkan bisa bereaksi dengan bahan yang dianggap lembam, seperti kaca.
Dengan adanya sedikit air, fluor dapat bereaksi dengan wadah gelasnya, membentuk silikon tetrafluorida, atau SiF4. Berbagai bahan kimia dapat dibentuk melalui reaksi halogen dengan unsur dan senyawa lain. Produk mereka dapat dikategorikan dengan cara berikut:
1. Hidrogen halida
Semua senyawa yang terbentuk dari reaksi antara hidrogen dan halogen. Contohnya adalah hidrogen fluorida, hidrogen klorida, dan hidrogen bromida. Ini pada dasarnya adalah garam tetapi, ketika dilarutkan dalam air, mereka menjadi asam, yaitu asam fluorida, asam klorida, dan asam bromida.
2. Halida logam
Ini adalah senyawa yang terbentuk dengan banyak jenis logam, termasuk logam alkali dan logam radioaktif seperti uranium (uranium heksafluorida). Ikatan bisa sangat ionik, seperti yang terbentuk dengan logam alkali. misalnya natrium klorida. Halogen juga dapat membentuk senyawa kovalen polimer dengan logam seperti paladium klorida. Umumnya, halogen dapat bereaksi langsung dengan logam, tetapi mereka juga dapat bereaksi melalui senyawa asamnya.
3. Senyawa interhalogen
Halogen juga dapat bereaksi dengan halogen lain untuk membentuk senyawa. Beberapa contoh termasuk bromin fluorida (BrF), yodium monoklorida (ICl), dan klorin monofluorida (ClF).
4. Halida organik
Banyak dari senyawa ini adalah sintetis, seperti polimer plastik, tetapi beberapa juga terjadi secara alami. Beberapa juga memiliki peran penting dalam fungsi biologis. Pada manusia, misalnya, ion klorida diperlukan untuk fungsi otak. Demikian pula, yodium dibutuhkan dalam jumlah yang sangat kecil untuk mensintesis hormon tiroid.
5. Senyawa polihalogenasi
Ini adalah senyawa sintetis dengan beberapa konstituen halogen. Mereka secara industri dibentuk sebagai produk limbah yang sangat beracun bagi manusia dan hewan lainnya. Namun, beberapa memiliki aplikasi praktis yang potensial.
Pola dalam tabel periodik di bawah ini untuk membandingkan tren energi ionisasi, afinitas elektron, jari-jari atom, dan karakteristik logam/nonlogam suatu unsur.
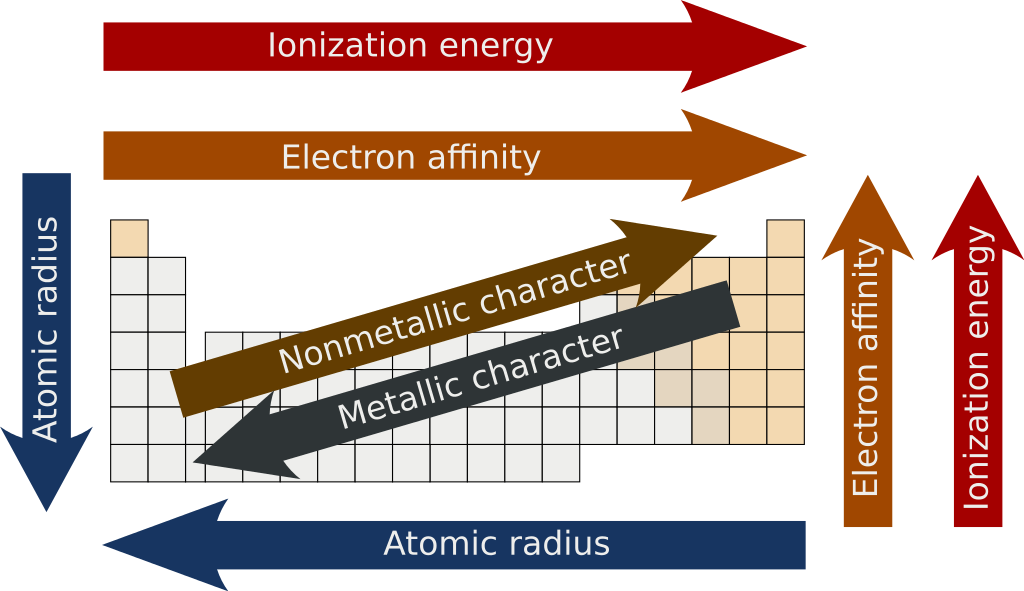
Seperti yang kita lihat, afinitas elektron dan energi ionisasi halogen cenderung menurun saat kita bergerak ke bawah kolom, yang disorot dengan warna biru pucat di sisi kanan tabel
Sifat Fisik Halogen
Pada suhu kamar, halogen bervariasi dalam bentuk materinya. Misalnya, fluor adalah gas, brom adalah cairan, dan yodium adalah padatan kristal. Astatin tidak pernah bentuk pada skala makroskopik tetapi mungkin semi metalik atau metalik. Sementara itu, tennessin adalah unsur sintetis yang sangat sementara dengan waktu paruh hanya beberapa milidetik.

Semua halogen sangat reaktif karena konfigurasi elektronnya. Mereka juga korosif dan beracun, menjadikannya disinfektan yang ideal, tetapi juga berpotensi sebagai senjata kimia. Dalam bentuk unsur, halogen harus disimpan dalam wadah inert seperti termos kaca tertutup. Penutupnya juga harus kaca. Gabus biasa atau sumbat karet tidak akan berfungsi karena halogen dapat menimbulkan korosi pada selulosa gabus dan polimer karet.
Saat kita melihan turun ke kolom golongan, titik didih unsur meningkat karena gaya Van der Waals antar molekul juga meningkat, seiring dengan ukuran atom dan massanya masing-masing. Ada juga korelasi antara berat atom dan titik didih suatu unsur.
Dalam hal energi ionisasi pertama dalam kilojoule per mol, energi yang dibutuhkan cenderung menurun saat kita lihat turun ke kolom. Sebagai contoh, energi ionisasi pertama klorin adalah 1.251,20 kJ/mol sedangkan energi ionisasi pertama iodin adalah 1.008,40 kJ/mol. Sekali lagi, ada korelasi yang jelas di sini antara berat atom dan energi ionisasi pertama.
Energi ionisasi pertama mengacu pada jumlah energi yang diperlukan untuk melepaskan elektron yang terikat longgar dari satu mol atom gas netral untuk menghasilkan satu lagi ion gas ratapan dengan muatan partikel positif (1+).
Dengan bertambahnya ukuran atom dan berat unsur, ikatan diatomik antara atom-atom dalam molekul halogen berkurang. Ini berarti ikatan menjadi lebih mudah putus dan atom tunggal juga menjadi lebih mudah terionisasi.

Unsur-unsur dalam Golongan Halogen
Golongan VII A(17) memiliki lima unsur alami dan satu unsur sintetik. Halogen memiliki sifat kimia dan fisik yang serupa, unsur sintetik dari kelompok ini adalah tennessin, memiliki beberapa sifat yang tidak mirip dengan halogen. Misalnya, unsur ini padat dan semi logam pada suhu kamar.
Berikut beberapa informasi penting tentang unsur-unsur dalam kelompok halogen